Основные проблемы токсичности, которые встречаются в аквариумной практике, связаны с действием азотистых соединений. Наиболее токсичны аммоний и нитриты. Нитраты наименее токсичны, однако они опасны, когда присутствуют в большом количестве и действуют достаточно долго. Токсичность нитритов в солоноватой и морской воде значительно ниже, чем в пресной.
Болезни как таковые в этой главе не рассматриваются, хотя в следующих разделах будет уделено определенное внимание контролю за факторами среды как средству предотвращения заболеваний водных животных. Общие вопросы болезней рыб и водных беспозвоночных достаточно полно освещены в многочисленных публикациях (Amlacher et а1., 1970; Bullock, 1971; Bullock et al., 1971; Dulin, 1976; Hoffman, 1967; Hoffman and Meyer, 1974; Johnson, 1978; Kabata, 1970; Kings-ford, 1975; Klontz, 1973; National Academy of Science, 1973; Pauley and Тпрр, 1975; Reichenbach-К11п1~е, Elkan, 1965; Sarig, 1971; Sindermann, 1977; Snieszko, 1970; van Duijn, 1973; Wellborn and Rogers, 1966). Обширная библиография приводится в работах Конроя (Conroy,1968), Джонсона (Johnson, 1968) и Зиндермана (Sindermamn, 197О). Проблемы иммунологии рыб обсуждали Андерсон (Anderson, 1974) и Лом (Lom, 1969), Рибелин и Мигаки (Ribelin and Migaki, 1975) опубликовали работу по патологии рыб.
8.1. Токсичность аммония.
Аммоний - наиболее токсичная форма из всех соединений неорганического азота, образующихся в аквариуме. Он образуется в воде в результате минерализации органических веществ гетеротрофными бактериями, а также как побочный продукт азотистого обмена гидробионтов (см. рис. 1.2).
Гидролиз аммония. Гидролиз аммония в природной воде, как показано ниже, идет при рК (константа равновесия) около 9, т.е. ионов аммония всегда больше, чем молекул свободного аммиака. Выявление факторов, влияющих на гидролиз аммония, очень важно, поскольку некоторые аквариумисты считают аммиак (NH3) более токсичным, чем ионы аммония (NH4+)
NH4 + H2O--><--NH3+H3O+ (24)
На ход реакции (24) оказывают влияние рН, температура и соленость, причем рН принадлежит решающая роль. Повышение рН на единицу вызывает десятикратное увеличение образования свободного аммиака. Повышение температуры воды и снижение солености увеличивают выделение аммиака не столь значительно. Температурный эффект обусловлен ускорением гидролиза ионов аммония при повышении температуры, влияние солености — уменьшением активности свободного аммиака в растворе возросшей ионной силы (Hampson, 1976). Таким образом, при одинаковой температуре, рН и содержании общего аммония (NH4-N) в растворе в морской воде содержится меньше NH3, чем в пресной (см. табл. 9.1).
Выделение аммония и его токсичность. Большинство водных животных являются аммонотелическими, т.е. свыше 50% азота выделяется у них в виде аммония преимущественно через жабры. Издавна считалось, что проникать в ткани может только аммиак (NH3), а аммоний такой способностью не обладает (Milne et al., 1958; Warren, 1962). В настоящее время от этой теории следует отказаться. Теперь стало ясно, что обе формы аммония способны проникать в ткани животных. Последние исследования доказали, что основной формой аммония, выделяемой через жабры рыбами и беспозвоночными, обитающими в воде любой солености, является NH4+ (Evans, 1973, 197i5; Kerstetter find Кее1ег, 1976; Maetz et а1., 197i6; Mangum et al., 1978; Рауап and Маей, 1973; Payan and Matty, 1975). Показано, что экскреция ионов аммония — обменный процесс, при котором метаболический NH4+ обменивается на поверхности жабр на ионы Na+ из воды. Значение экскреции аммиака окончательно не выяснено из-за отсутствия необходимой информации.
Механизм токсического действия аммония также должен быть пересмотрен. Ранее считалось, что токсичность связана с градиентом парциального давления аммиака при прохождении его через жабры. Предполагалось, что по мере увеличения парциального давления аммиака в воде NH3 диффундирует в организм животного по градиенту концентрации. Это могло быть так, если бы содержание NH3 в воде превышало его содержание в крови. Однако сейчас этот механизм выглядит сомнительным. Фромм и Жиллет (Fromm and Gillette, 1968) показали, что при содержании радужной форели (Salmo gairdineri) в воде с возрастающей концентрацией аммиака содержание его в крови также увеличивалось, однако оно всегда оставалось выше содержания NH3 во внешней среде. Этим авторам не удалось экспериментально доказать возможность проникновения аммиака в жабры рыб извне. Они предположили, что возрастание концентрации аммиака в воде вызывает усиленное накопление метаболического аммония в тканях, который и вызывает токсикоз. Косвенно эту гипотезу подтвердили Фромм и Жиллет (Fromm and Gillett, 1968) и Олсон и Фромм (Olson and Fromm, 1971), которые обнаружили, что интенсивность выделения аммония радужной форелью снижалась по мере возрастания содержания аммиака в воде. Дальнейшие эксперименты должны дать ответ на вопрос, каким образом аммиак проникает в жабры водных животных и вызывает отравление. До тех пор следует считать, что высокое содержание аммиака в воде оказывает косвенное токсическое действие, истинное отравление происходит из-за того, что животные не могут освободиться от избытка аммония, накапливающегося в ходе азотистого обмена.
рН воды оказывает влияние на токсичность аммиака, поскольку регулирует гидролиз NH4+. С повышением рН количество свободного аммиака возрастает пропорционально концентрации ионов аммония (NH4+), а аммиак, по мнению специалистов,— более токсичная форма (Armstrong et al., 1978; Burkhalter and Кауа, 1977; Fromm and Gillette, 1968; Hampson, 1976; Robinette, 1976; Robin, Elmaraghy, 1977; Schreckenbach et al., 1975). Обе формы аммония проникают через тканевый барьер, как уже отмечалось, обе ядовиты, хотя NH3 при высоком рН более токсичен, чем NH4+ (Armstrong et аl., 1978).
При низком содержании в воде растворенного кислорода токсичность аммония усиливается, хотя механизм этого явления не вполне ясен.
Рейхенбах-Клинке (Reichenbach-,Klinkе, 1967) отмечал, что в тканях некоторых видов европейских пресноводных рыб по мере возрастания концентрации NH3 содержание кислорода уменьшалось, в условиях дефицита кислорода в воде у рыб понижалась устойчивость к аммиаку. Некоторые другие исследователи подтверждают, что токсичность NH3 значительно возрастает в воде с пониженным содержанием кислорода (Downing and Merkens, 1955; Larmoyeux and Piper, 1973; Lloyd, 1961; Merkens and Downing, 1957; Smith, 1972; Smith and Piper, 1975; Wuhrmann and Woker, 1948, 1953).
Согласно одной из теорий высокое содержание аммиака в воде каким-то образом связано со способностью гемоглобина удерживать кислород. РейхеноахКлинке (Reichenbach-iKlinke, 1967) отметил уменьшение количества красных кровяных клеток у пресноводных рыб после того, как их выдерживали в воде с сублетальной концентрацией аммиака. Броквей (Brockway, 1950) сообщал, что когда концентрация NH4 - N в воде достигла 1 мг/л, содержание кислорода в крови радужной форели снизилось на 14% по сравнению с нормальным, а углекислоты - увеличилось почти на 15%. Вместе с тем Фромм и Жиллет (1968), исследуя in vitro эритроциты, помещенные в раствор Рингера, отмечали, что даже при повышении концентрации NH4 - N до 10 мг/л способность гемоглобина связывать кислород заметно не изменялась. Сауса и Мид (Sousa and Meade, 1977) изучали с помощью спектрофотометра раствор гемоглобина у кижуча, содержавшегося в воде с высокой концентрацией аммония. Они отметили постепенное смещение адсорбционной конфигурации насыщенного кислородом гемоглобина в сторону деоксигенации. Исследователи заключили, что длительное пребывание в среде, насыщенной аммиаком, ведет к ацидемии. Это в свою очередь нарушало способность гемоглобина переносить кислород. Ацидемия, сопровождающаяся нарушением внутреннего кислотно-щелочного баланса, ведет к преждевременному отщеплению кислорода (эффект Бора).
8.2. Токсичность нитритов.
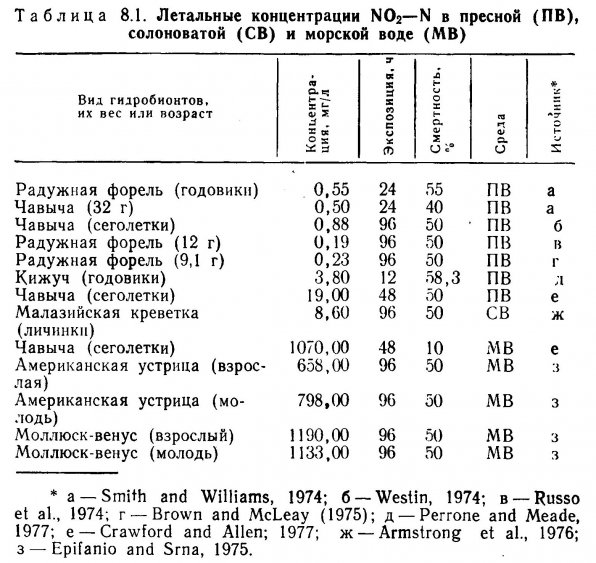
Содержащиеся в крови нитриты окисляют гемоглобин до метгемоглобина, который неспособен переносить кислород (Jaffe, 1964). Присутствие у рыб метгемоглобина можно определить по цвету крови и жабр, которые становятся коричневыми. Ранее предполагали, что появление в крови метгемоглобина коррелирует с повышенной смертностью водных животных, но это не всегда так, особенно если сопоставить смертность животных в морской и пресной воде в биопробе. Кроуфорд и Аллен (Crawford and Allen, 1977) показали, что 70% сеголетков чавычи, содержавшихся в пресной воде с концентрацией NO> — N 8,18 мт/л, погибали при содержании метгемоглобина 44%. Смертность той же молоди, находившейся в морской воде с концентрацией NO2 — N 246,97 мг/л, составила всего 10% при концентрации метгемоглобина в крови 74%.
В табл. 8.1 представлены некоторые опубликованные данные по токсичности нитритов в пресной, солоноватой и морской воде. Хорошо заметно, что по мере возрастания солености среды смертность животных уменьшается. Кроуфорд и Аллен (1977) объясняли это защитным действием ионов кальция, однако не исключали возможности сходного влияния и других присутствующих ионов. Перрону и Миду (Perrone and Meade, 1977) удалось доказать, что защитную функцию выполняют хлориды. Смертность годовиков кижуча, которых в течение 48 ч выдерживали в воде с содержанием нитритов (в виде NO2 — N) 29,8 мг/л и хлоридов (в виде Cl) 261,3 мг/л, не отмечена. При выдерживании другой группы в воде с концентрацией NO2 — N 3,8 мг/л и хлоридов 2,5 мг/л уже через 12 ч погибло 58,3% всей молоди. Механизм действия защитных ионов неясен, но возможно, что катионы, присутствующие в соленой воде, соединяясь нитритами, препятствуют их поглощению рыбой из раствора. Ионы хлора могут непосредственно заметить ионы нитритов, а поскольку их концентрация в растворе значительно выше, хлориды затрудняют ассимиляцию нитритов. Нитриты при любой концентрации не представляют серьезной угрозы для животных в морских и солоноватоводных аквариумах, однако их присутствие в пресной воде даже в малых количествах, безусловно, очень опасно.
8.3. Токсичность нитратов.
Нитраты даже в больших концентрациях не являются остротоксичными для водных животных, хотя их действие на протяжении длительного времени не изучалось. Возможно, что бледная окраска жабр, развивающаяся у рыб спустя несколько месяцев содержания в аквариуме, - результат действия накапливающихся нитратов, однако это только предположение.
Кнепп и Аркин (Knepp and Arkin, 1973) сообщали, что присутствие в воде нитратов NО3 — N в концентрации 400 мг/л не оказывало влияния на выживаемость и рост пресноводных большеротого окуня (Micropterus salmoides) и канального сомика (Ictalurus punctatus). Более высокие концентрации не изучались. Уэстин (Westin, 1974) определил, что для чавычи (Oncorhynchus tshawytscha) и радужной форели, содержавшихся прecной воде, нитраты в 2000 раз менее токсичны, чем нитриты. У чавычи признаки расстройства функций при концентрации нитратов NО3-N 1000 мг/л или несколько меньше наблюдались на пятый-восьмой день. Они выражались в неспособности плавать по прямой, затрудненном дыхании, пониженной активности, в сочетании с нескоординированными движениями. У некоторых рыб жаберные лепестки приобретали цвет от бледно-розового до темного красно-коричневого. Было отмечено, что нитраты более токсичны в солоноватой (15%о) воде. Для лососей токсичность нитратов была в 1,14 — 1,41 раза выше при содержании в солоноватой воде, чем в пресной. Для адаптированной к солоноватой воде форели токсичность нитратов оказалась в 1,24 — 1,38 раза выше, чем в пресной воде.
Хираяма (Hirayama, 1966) отмечал увеличение дыхательной активности у обыкновенного осьминога (Octopus vulgaris), которого поместили в морскую воду с пониженной щелочностью и рН и высоким содержанием нитратов. Животное погибло спустя 7 ч при содержании нитратов 1400 мг/л. Куватани и др. (Kuwatani et al., 1969) пришли к выводу, что нитраты в концентрации 1000 мг/л не оказывают влияния на рост моллюска японской жемчужницы (Pinctata fucada) до тех пор, пока рН морской воды остается выше 8,05.
Эпифанио и Срна (Epifanio and Srna, 1975) показали, что высокая концентрация нитратов не оказывала вредного влияния на развитие двух видов двустворчатых моллюсков, содержавшихся в слабосоленой морской воде (8=27%о). При экспозиции 96 ч ЛД50 нитрата натрия для взрослых особей американской устрицы (Crassostrea virginica) составила 2604 мг/л и 3794 мг/л для молоди. Даже когда концентрация NaNO3 достигала 75% общей солености, не удалось вызвать 50%-ную гибель двустворчатого моллюска венуса (Nercenaria тегсепаIia). Исследователи решили, что испытывать более высокие концентрации нет необходимости.
8.4. Токсичность тяжелых металлов.
Основные тяжелые металлы (Cr, Pb, Hg, Cu, Zn) присутствуют в воде в ничтожно малых количествах. Если их концентрация возрастает (оставаясь очень низкой), все они становятся токсичными для водных животных. Многие из них вызывают гибель гидробионтов при концентрации менее 1,0 мг/л. В этом разделе рассмотрено действие двух тяжелых металлов: цинка и меди, так как их часто применяют для лечения заболеваний морских рыб, вызванных простейшими.
Через некоторое время после внесения в аквариум токсичность цинк или медьсодержащих веществ снижается, так как ионы тяжелых металлов оседают в виде кароонатов. Эффективность осаждения тяжелых металлов зависит не от жесткости воды или концентрации катионов, а от ее щелочности. В растворенном виде, как цинк, так и медь вызывают у рыб обильное выделение слизи. Слизь выделяется в воду вместе с инцистированными формами некоторых паразитов. Считалось, что паразитические простейшие, например Cryptocarion irritans, более восприимчивы к действию тяжелых металлов на стадии «бродяжек», поэтому обработка цинком или медью нейтрализует эти организмы прежде, чем они прикрепятся к хозяину. Однако в лабораторных условиях in vitro это не подтвердилось.
У рыб, подвергшихся действию токсических концентраций меди и цинка, резко усиливается дыхательная активность (Jones, 1938, 1939; Sellers et al., 1975). Некоторые исследователи отмечали, что тяжелые металлы, нарушая нормальный газообмен, вызывали гипоксию (кислородное голодание) тканей (Ellis, 1937; Skidmore,1964; Vernon, 1954). Бертон и др. (Burton et al., 1972) пришли к выводу, что основной причиной гибели рыб, обработанных медью, является гипоксия тканей, вызванная коагуляцией и оседанием слизи на жабрах и сопровождающаяся повреждением клеток тканей жабр. Гистопатологические изменения жаберной ткани у рыб, подвергавшихся действию тяжелых металлов, описаны в литературе. Так, Бейкер (Baker, 1969) отмечал, что у зимней камбалы (Pseudopleuronectes americanus) под действием невысокой концентрации меди жаберные лепестки сморщиваются, эпителиальный слой вакуолизирован, число слизеобразующих клеток в жаберных лепестках уменьшается. Маттиосен и Брефилд (Matthiessen and Brafield, 1973) заметили сражение вторичного плоского эпителия у трехиглой колюшки (Gasterosteus aculeatus) под действием цинка.
Тяжелые металлы вызывают и другие опасные поражения, включая ослабление активности ферментов (Christensen, 19?1, 1972; Jackim et al., 1970), нарушение ионной регуляции (Lewis and Lewis, 1971), гипергликемию или увеличение содержания глюкозы в крови (Watson and NcKeown, 1976) и другие изменения гематологических показателей (Cardeilhac and Hall, 1977; McKim et al., 1970). Гарднер и Лярош (Gardner and LaiRoche, 1973) сообщали, что под действием меди наблюдаются изменения клеток механорецепторов канала боковой линии на голове взрослых особей фундулуса (Fundulus heteroclitus) и атлантической атерины (Nenidia menidia), а также поражения зрительных органов и почек, геморрагия мозга и прилежащих к нему периорбитальных тканей.
8.5. Иммунитет рыб и внешняя среда.
Несмотря на обширную литературу по лечению заболеваний водных животных, о профилактике заболеваний путем тщательного контроля за внешней средой написано сравнительно мало. В данном разделе сделана попытка установить причинно-следственные связи инфекционных заболеваний и условий обитания. Естественно, любая попытка такого рода не претендует на полноту исследования, поскольку зависимости между заболеваниями и стрессовыми факторами не вполне очевидны.
Данные, приведенные в предыдущих главах, свидетельствуют о том, что водные животные чутко реагируют на малейшие изменения качества воды. Следует еще раз отметить, что хотя большинство гидробионтов способны до некоторой степени регулировать свои ответные реакции на изменения внешней среды, в неволе эти реакции многократно усиливаются. В природе естественное распределение паразитов и хозяев позволяет видам-хозяевам выжить, хотя под действием неблагоприятных факторов много отдельных особей может погибнуть. В условиях изоляции плотные посадки способствуют распространению паразитов. При недостаточном контроле за качеством воды паразиты могут так размножиться, что полностью уничтожат своих хозяев. В этих условиях любые защитные системы хозяев быстро подавляются преобладающим числом инфекционных организмов.
Патогенные организмы присутствуют у всех водных животных, однако подлинную опасность в аквакультуре представляют инфекционные формы. Степень поражения зависит главным образом от физиологического состояния хозяина, а оно в свою очередь определяется условиями внешней среды. У здоровых животных инфекция находится в латентном (скрытом) состоянии, паразиты присутствуют, но не вызывают заболеваний. Возбудителями большинства эпизоотий в аквариумах являются бактерии и простейшие. Численность этих организмов можно поддерживать на безопасном уровне путем строгого контроля за качеством воды.
Вирулентность гельминтов и ракообразных паразитов в меньшей степени зависит от качества среды обитания хозяина. Тяжелым поражениям зачастую подвергаются внешне здоровые животные, несмотря на контроль за такими гидрохимическими показателями, как температура, содержание растворенного кислорода и аммония. Заболевших животных приходится лечить.
Паразитические бактерии, простейшие, а также вирусы представляют в аквариумах большую опасность, чем гельминты и ракообразные паразиты. Методы борьбы с последними описаны ниже. Бактерии и простейшие обычно поселяются на жабрах и внутренних полостях гидробионтов. Останутся они в латентной форме или станут инфекционными, зависит от физиологического состояния хозяина. Временное уменьшение содержания кислорода, увеличение концентрации свободной углекислоты, аммиака и, очевидно, растворенных органических веществ (РОВ) ослабляют хозяина. По мере увеличения концентрации общего растворенного углерода размножаются гетеротрофные бактерии, и если их окажется достаточно много, обычно безопасные формы могут стать инфекционными. Колебания температуры вызывают стрессовое состояние у животного-хозяина, что впоследствии приводит к хроническому поражению простейшими паразитами зачастую уже после того, как температура пришла в норму.
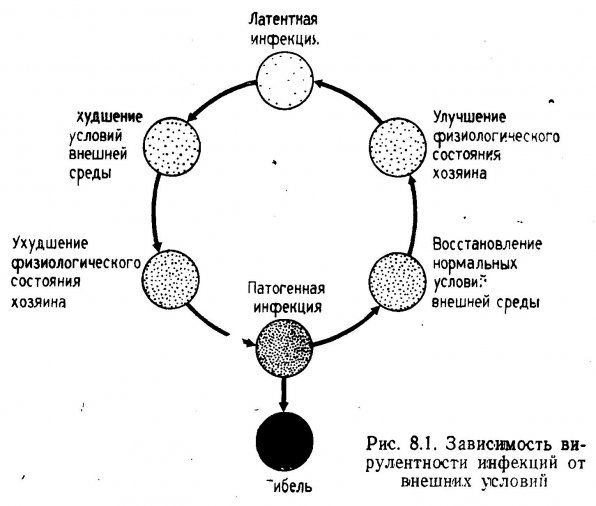
Бактериальные и протозойные инфекции часто развиваются тогда, когда в сбалансированный аквариум подсаживают новых животных. Широко распространено мнение, что болезнетворные микроорганизмы привносятся вместе с новыми животными и передаются акклиматизированным особям, однако проблема оказалась гораздо сложнее. Например, если «старожилы» и вновь подсаженные особи поражены одним возбудителем, но в скрытой форме, посадка новых животных может вызвать переход латентной инфекции в болезнетворную. Причины могут быть разными, например повышение концентрации аммиака при временном изменении производительности фильтра, возрастание содержания РОВ или увеличение концентрации СО2 в плохо забуференной зоне. Другими словами, первопричиной гибели животных являются изменения гидрохимических показателей воды, хотя заметным обстоятельством является только подсадка животных. Как показано на рис. 8.1, ухудшение качества воды снижает устойчивость хозяина к болезни и способствует переходу возбудителя из латентюй формы в инфекционную.
Слизь на внешних покровах водных животных защищает их от проникновения эктопаразитов и позволяет поддерживать соотношение паразит — хозяин в пользу хозяина. Доказано, что слизь содержит антитела, которые уничтожают паразитических простейших (Lom, 1969). Синтез антител в организме холоднокровных животных зависит от температуры воды. В зависимости от вида рыбы общее количество антител в слизи уменьшается при отклонении температуры в ту и другую сторону от оптимального уровня. Лом (Lom, 1969) отмечал, что при повышении температуры воды до 20' триходины отпадали от карпа, так как «...защитные свойства слизи проявляются только при повышенной температуре». При 10С рыба неспособна самостоятельно освободиться от паразитов, хотя рост триходин при низкой температуре замедлен.
Колебания температуры воды и накопление вредных продуктов обмена — вот две основные причины, вызывающие вспышки инфекционных заболеваний и инвазий.
8.6. Профилактика заболеваний.
Профилактические мероприятия сводятся к поддержанию благоприятных условий среды (включая качество воды и постоянную температуру); стерилизации циркулирующей в аквариуме воды; обеспечению нормального питания рыб и предупреждению попадания в систему инфекционных организмов извне. Первые два фактора рассматривались в предыдущих главах. Обсуждение третьего не входит в задачу данной книги, а четвертый рассмотрен ниже.
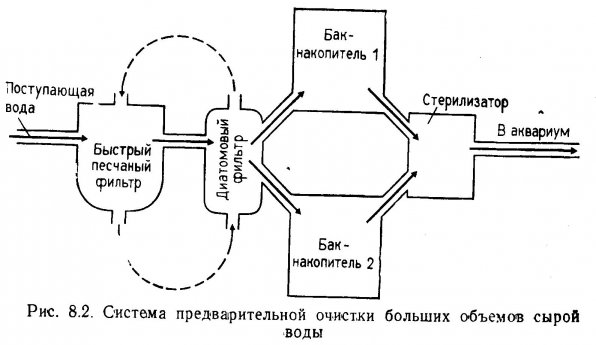
Сырая вода. В природной необработанной воде присутствуют множество болезнетворных организмов, поэтому никогда не следует заполнять систему водой непосредственно из естественных источников. Сменную воду для аквариума следует предварительно профильтровать на быстром песчаном фильтре для удаления первичных взвесей. Затем ее пропускают через диатомовый фильтр. Диатомовый фильтр — эффективное средство против бактерий и простейших, которые прошли через песчаный фильтр. Затем воду в течение 2 недель держат в затененном баке и умеренно аэрируют.
Большинство паразитов за это время погибают из-за отсутствия хозяев. Это означает, что для замены 10% воды, которая производится раз в 2 недели в каждом аквариуме, необходимы, по крайней мере, два бака с достаточным количеством воды. Вместимость каждого бака должна быть достаточной для подключения к системе нового аквариума.
В замкнутых системах предварительная фильтрация сырой воды осуществляется периодически, фильтры используются непродолжительное время. Система предварительной очистки (последовательно установленные песчаный и диатомовый фильтры в комплексе) должна быть спроектирована так, чтобы фильтры могли работать по замкнутому циклу независимо от накопительных баков и аквариумов. Такое устройство схематически показано на рис. 8.2 пунктирными линиями. На рис. 8.2 показан также стерилизатор (УФ-лампа или озонатор). Перед подачей в аквариум вода после двухнедельного отстаивания должна пройти через стерилизатор. Сразу после обработки порции воды систему предварительной очистки дезинфицируют химическими веществами, промывают и держат сухой до следующей фильтрации. Стерилизация озоном или УФ-лучами для обеззараживания системы в этом случае неэффективна, так как неспособна нейтрализовать микроорганизмы, находящиеся в глубине песчаного слоя, а также бактерий на фильтровальных элементах, стенках и трубах диатомового фильтра. Лучшее средство для дезинфекции фильтров — хлорирование, необходимо только тщательно удалять все следы хлора после очистки.
Хлорирование системы предварительной очистки.
1. Воду переключают так, чтобы система предварительной очистки функционировала как замкнутая.
2. Промывают диатомовый фильтр обратным током воды. (Без грунтовки).
3. Добавляют гипохлорит натрия, чтобы содержание свободного хлора составляло 50 мг/л (методику см. American Water Works Association et al., 1975) .
4. Включают насосы и пропускают хлорированную воду через фильтры в замкнутом режиме в течение 2 ч.
5. Добавляя в воду тиосульфат натрия (Na2S203), доводят содержание свободного хлора до нуля. Количество тиосульфата может варьировать и поэтому для каждого конкретного случая определяется опытным путем.
6. Спускают воду из фильтров и оставляют их сухими до обработки следующей порции сырой воды.
7. Во время нового цикла очистки прежде, чем отводить воду в бак-накопитель, промывают систему сильной струей воды в течение 30 мин.
Подсадка животных. Новые партии животных следует подсаживать в основную систему только после того, как они пройдут карантин в течение 4 недель, и станет ясно, что они свободны от инфекционных микроорганизмов или внешних паразитов.
Живые корма. Если живые корма выращивают в искусственных условиях, они полностью безопасны. Так, широко культивируемая артемия (Artemia salina) пригодна для кормления как пресноводных, так и морских животных. Живые корма, заготовленные в естественных водоемах,— потенциальные носители паразитов. Во всех случаях кормовые организмы соленых вод нельзя скармливать морским и солоноватоводным видам животных, пресноводные пищевые организмы не следует скармливать видам, обитающим в пресной воде. Дело в том, что паразиты, обитающие на морских кормовых организмах, редко выживают в пресной воде, именно поэтому они безопасны для пресноводных животных. И наоборот, пресноводные формы, например Daphnia, безопасны для морских животных. Хищным пресноводным видам не следует давать мелких карповых рыб, хотя они безопасны для морских рыб. Во всех случаях с точки зрения предупреждения распространения заболеваний готовые искусственные смеси предпочтительнее живых кормов или мороженой рыбы.
8.7. Лечение заболеваний.
Без надлежащего контроля процессы поддержания стабильных условий внешней среды и лечения заболеваний являются взаимоисключающими. Слишком поспешное применение лечебных средств может усугубить и без того сложную ситуацию, уничтожив полезные микроорганизмы фильтровального слоя. В этом случае качество воды быстро ухудшается, и неблагоприятная ситуация еще более осложняется. Проводя любые лечебные мероприятия, следует помнить о возможных последствиях ухудшения качества воды. В неумелых руках урон от лечения может быть больше, чем от болезни. В большинстве случаев не стоит лечить животных, пораженных бактериями или простейшими. Гибель рыбы от этих организмов, как уже отмечалось выше, часто вызвана неблагоприятными условиями внешней среды. Тяжелопораженных животных следует удалить, а все силы сосредоточить на исправлении сложившейся гидрохимической ситуации. В улучшенных условиях умеренно пораженные животные обычно выживают.
Гельминты и ракообразные паразиты более устойчивы к иммунным реакциям хозяев, с ними сложнее бороться одним лишь улучшением качества воды. Единственный надежный способ избавиться от этих паразитов — высадить всех животных и прохлорировать аквариум и фильтрационную систему. При двухчасовой экспозиции вполне достаточна концентрация свободного хлора 50 мг/л. Для ликвидации следов хлора добавляют тиосульфат натрия, систему осушают и тщательно промывают водопроводной водой. Затем аквариум следует заполнить свежеприготовленной водой и снова сбалансировать, используя акклиматизированных животных, прошедших карантин. Эта процедура, безусловно, трудоемка, но эффективна. При наличии строгого контроля за качеством воды тяжелые поражения гельминтами и ракообразными паразитами встречаются крайне редко.
Вопросы выбора лекарственных средств для лечения конкретных заболеваний широко обсуждались в литературе, поэтому здесь рецепты не приводятся. Однако при выборе лекарств следует учитывать следующее: лекарства должны быть максимально специфичными для данной инфекции; лекарственных средств, которые вызывают у водных животных обильное выделение слизи, необходимо избегать. Если удалить слизь, животные оказываются беззащитными перед повторным заражением другими микробами. По этой причине тяжелые металлы рекомендуется применять очень осторожно. Заболевших животных ни в коем случае нельзя лечить прямо в аквариуме. Некоторые физиотерапевтические средства подавляют нитрификацию (см. раздел 1.2). Именно поэтому бассейны для лечебной обработки, оборудованные биологическими фильтрами, редко функционируют нормально.
8.8. Практическое руководство.
Данные, подтверждающие повышенную токсичность аммиака (NH3) по сравнению с ионами аммония (NH4+), были получены в опытах с биопробой на уровне целых организмов (Lloyd and Orr, 1969; Wuhrmann and Poker, 1948). Этот факт можно будет считать доказанным, если такие же различия в токсичности будут установлены на клеточном уровне. Вопрос, однако, представляет чисто академический интерес, поскольку условия, определяющие гидролиз аммония в аквариуме (рН, температура и соленость), невозможно изменить, не вызывая других опасных последствий. Например, данные о том, что аммиак менее токсичен при низком рН, малоутешительны для специалистов, занимающихся морским аквариумом. Опыт показывает, что морские животные по непонятной причине лучше себя чувствуют при рН 8 и выше. Возможно, в этом диапазоне рН обменные процессы через жабры и наружные покровы наиболее эффективны. Температуру и соленость необходимо поддерживать в строгих пределах, что важно уже само по себе. Резкие изменения температуры воды оказывают отрицательное влияние на ферментативные системы пойкилотермных животных. Нельзя увеличивать ионную силу пресной аквариумной воды (повышать соленость) для уменьшения концентрации свободного аммиака.
Температуру, рН и соленость необходимо поддерживать в определенных пределах в соответствии с экологическими и физиологическими потребностями аквариумных животных и растений. Интенсивная аэрация позволяет ослабить токсическое действие аммиака на водных животных. Удаление несъеденных остатков пищи, погибших животных и растений, регулярная замена части воды в аквариуме, умеренные плотности посадки животных и растений — наиболее эффективные средства предупреждения увеличения концентрации аммиака в растворе. Верхний предел содержания общего аммония не должен превышать 0,1 мг/л.
Нитриты остротоксичны, по-видимому, только в пресной и слабосоленой воде, однако это заключение основывается на ограниченных данных, поэтому верхний предел содержания нитритов в любых аквариумах не должен превышать 0,1 мг NO2-N/л. Данные о длительном воздействии нитратов на водных животных отсутствуют, а их кратковременным воздействием можно пренебречь, так как нитраты не относятся к высокотоксичным соединениям. Вместе с тем при высоких концентрациях нитраты не могут не оказывать вредного влияния, поэтому их содержание не должно превышать 20 мг NO3 — N/л. Ограничение содержания в воде нитратов достигается регулярной заменой части воды и посадкой в аквариум растений, которые периодически удаляются по мере отрастания *.
* Прим. ред. Большинство современных исследователей считают допустимым содержание значительных количеств нитратов в системах с оборотным водоснабжением при выращивании тепловодных рыб. Например, по данным Л. Нэгеля, Ч. Меске и Х. Мудрака (Nagel, Meske and Mudrack, 197б), двухлетки карпа нормально росли при концентрации 1000 — 1800 мг Nos — N/л, достигая за 6 мес средней массы 900 г.
Опыт показывает, что лечение рыб тяжелыми металлами не дает положительных результатов. В большинстве случаев неблагоприятное воздействие этих средств на хозяина сводит на нет положительный эффект от удаления паразитов. До сих пор не установлены летальные дозы меди или цинка для некоторых видов морских рыб. Обработка аквариума, в котором содержится сразу много видов, особенно недопустима, поскольку длительность действия и летальные дозы у разных видов рыб резко различаются. Более того, до сих пор неясно, как действуют тяжелые металлы на разных стадиях жизненного цикла паразита, т.е. обработка может оказаться более опасной для хозяина, чем для паразита.
Количество меди или цинка, которое остается после обработки аквариума в растворенном состоянии, трудно определить. Накопление детрита на поверхности фильтра наряду с высокой концентрацией растворенных органических веществ в толще воды оказывает значительное влияние на дозу цинка и меди, которую способны переносить микроорганизмы и аквариумные животные и растения. Известно, что органическое вещество активного ила, связывая медь, уменьшает ее токсическое действие на нитрифицирующих бактерий (Tomnsson et al., 1966). Образование комплексных циклических соединений меди (хелатов), очевидно, делает ее менее токсичной для пресноводных рыб (Doudoroff and Katz, 1953). Фитцджеральд (Fitzgerald, 1963) показал, что реакция сульфата меди с лимонной кислотой с образованием хелата уменьшает токсическое действие меди на пимефалес (Pimephales notatus) в 500 раз. Образование хелатных соединений способствовало удержанию 90% меди,в растворенном состоянии при рН 6,0 и 8,5.
Хелатные комплексы меди и цинка применяют при обработке морских аквариумов, когда требуется продлить действие меди в растворенном состоянии. Устойчивые к действию хелатов тяжелых металлов гетеротрофные бактерии часто разрушают органическую основу хелатных молекул, в результате освободившиеся ионы тяжелых металлов соединяются с карбонатами и выпадают в осадок (инактивируются). Знаменательно, что ни в одном из рекомендуемых для обработки морских аквариумов нормативов не учитывается растворенное органическое вещество (РОВ) как фактор, изменяющий токсические свойства ионов металлов. Образование хелатов, как уже отмечалось, уменьшает токсическое воздействие тяжелых металлов на рыб. По-видимому, их действие на паразитов аналогично (Spotte, 1970).
Токсичность тяжелых металлов проявляется в затруднении дыхания и гипоксии тканей животных, поэтому любая обработка воды солями меди или цинка должна сопровождаться усиленной аэрацией. Больных рыб необходимо высадить из аквариума и обработать в отдельном контейнере. Следует проследить, чтобы в контейнере не было содержащего кальций гравия, а в воде отсутствовали растворенные органические вещества. Выпавшие в осадок тяжелые металлы невозможно удалить традиционными способами (например, частичной заменой воды или физической адсорбцией). Воду, обработанную тяжелыми металлами, не следует подвергать очистке активированным углем или в пеноотделительных колонках, так как и в том и в другом случае из раствора быстро извлекаются хелатные соединения этих металлов. Озонирование может также разрушить органическую основу молекул, содержащих тяжелые металлы, освобождая тем самым ионы металлов, которые соединяются с карбонатами и выпадают в осадок.
|


